Les activités de recherche de l’équipe Radiation et Vivant (REV) s’inscrivent dans ce contexte thématique et visent 3 objectifs fédérateurs:
- développer de nouvelles approches expérimentales et méthodologiques afin de mieux comprendre les effets des radiations ionisantes sur le vivant;
- améliorer le contrôle de la dose déposée en radiothérapie externe et interne;
- et renforcer l’efficacité des méthodes de traitement en radiothérapie moléculaire à travers la production de nouveaux radionucléides, le développement de nouveaux chélateurs pour mieux cibler les tissus à traiter ou à imager, et la mise en œuvre de protocoles de dosimétrie individualisés plus précis.
Ces objectifs se déclinent selon trois grands axes :
1) Étude de l’effet des radiations ionisantes de l’échelle cellulaire à l’échelle tissulaire : projets « Effets des radiations sur la croissance tumorale » et « Études des relations RBE/LET ».
Le projet « Effets des radiations sur la croissance tumorale » vise à étudier de manière systématique et comparative les effets métaboliques subcellulaires létaux ou sub-létaux ainsi que les effets biologiques macroscopique sur la prolifération, la migration et la morphologie cellulaires induits par différents types de rayonnement (X, gamma, H, C, O, Ne) et différentes modalités d’irradiation (fractionnement de la dose, nanoparticules radiosensibilisantes). Les méthodes d’analyse utilisées incluent la biologie cellulaire (culture et suivi de croissance), la biochimie (détection de paramètres métaboliques), les techniques optiques (videomicroscopie à épifluorescence pour l’obtention des données de croissance tumorale et spectroscopie IR pour l’analyse des modifications macromoléculaires) et l’expérimentation animale (étude de la croissance tumorale). L’un des objectifs est plus particulièrement d’étudier l’effet des interactions entre les cellules saines et irradiées sur la croissance tumorale (effet bystander). Ces travaux sont menés en lien avec l’équipe Modélisation et Vivant.
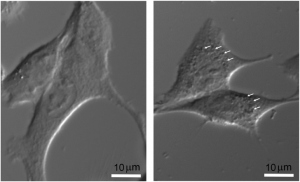
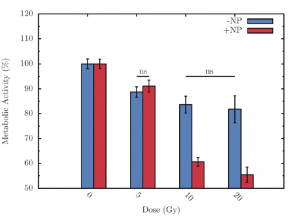
Internalisation de nanoparticules radiosensibilisantes dans des cellules F98 de gliome murin, et suivi de la viabilité cellulaire en fonction de la dose de radiations X avec ou sans nanoparticules (Gd).
Collaborations: Institut Curie (doses, irradiation, …), société Nanobactérie SARL (nanoparticules et financement CIFRE), synchrotron ALBA (Barcelone)
2) Dosimétrie multi-échelle pour le contrôle de la radiothérapie interne: projet THIDOS
Le projet THIDOS vise à renforcer le contrôle de la dose délivrée lors du traitement à l’iode radioactif des maladies thyroïdiennes en réduisant les incertitudes liées au calcul des doses. Ce projet repose principalement sur la mise au point d’une gamma-caméra ambulatoire à haute résolution spatiale spécifiquement conçue pour améliorer la mesure quantitative de la biocinétique de l’Iode 131 au niveau de la thyroïde et des organes à risques avant et après l’administration du traitement. Le deuxième axe, piloté par l’RSN, porte sur l’analyse de la fiabilité et de la qualité des calculs dosimétriques basés sur l’intégration de différentes données cliniques (fonctionnelle, anatomique ou pharmacocinétique), à travers la mise en œuvre de méthodes de propagation d’erreurs innovantes telles que les réseaux bayésiens pour estimer les incertitudes liées à la dose. Le projet THIDOS est financé par le plan Cancer (AAP Physicancer, INSERM).

Prototype de gamma-caméra mobile pour la mesure quantitative de la dose au niveau des organes pendant la radiothérapie.
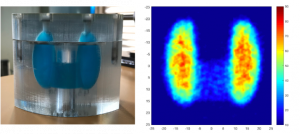
Mesure de la dose de 131I à l’aide du prototype de gamma-caméra sur un modèle (fantôme) de thyroïde.
Collaborations: Laboratoire d’évaluation de la dose interne (LEDI-IRSN) (dosimétrie), Institut Claudius Régaud (Institut Universitaire du Cancer de Toulouse Oncopole) (Evaluation clinique), National Centre of Microelectronics (CNM-CSIC) (microélectronique), Nuclear Physics Institute (Prague) et Univ. Santiago de Compostela (dosimétrie), Institute for Corpuscular Physics (IFIC, Valencia) (électronique) et European Radiation Dosimetry Group (membres associés).
3) Outils pour la production et la mise en œuvre de nouveaux radio-isotopes pour la radiothérapie interne : projet PRISM
Les besoins en radio-isotopes médicaux sont actuellement importants, notamment dans le domaine des pathologies cancéreuses. Le projet PRISM propose de produire de nouveaux radionucléides difficiles à produire actuellement, à travers le développement d’une méthodologie permettant d’en assurer la disponibilité en quantité et en qualité suffisante (pureté chimique et isotopique) afin de favoriser leurs évaluations pré-cliniques. Il s’intéresse plus particulièrement aux isotopes du Terbium qui permettent une approche théranostique, couplant imagerie TEP (152Tb, 155Tb) et thérapie alpha ou beta (149Tb, 161Tb), avec un même support radiopharmaceutique (ensemble chélateur-vecteur). Les objectifs sont de lever deux verrous en proposant, d’une part, d’utiliser du 155Gd de haute pureté produit par SIDONIE (séparateur unique en Europe pour ses qualités de séparation) pour réaliser la réaction 155purGd(p,n) vers 155Tb (en démontrant la possibilité de produire 149Tb,152Tb et 155Tb de manière concomitante avec SIDONIE) et, d’autre part, d’optimiser un chélateur original qui, conjugué avec des anticorps monoclonaux, permettra d’être radiomarqué au Tb dans des conditions non dénaturantes du vecteur biologique.

Dispositif SCALP/SIDONIE pour la production et séparation isotopique (IJC Lab).
Collaborations: Subatech (Nantes), ARRONAX (St Herblain), ICMUB (Institut de Chimie Moléculaire de l’Université de Bourgogne, Dijon), IC-UNISTRA (Institut de Chimie de Strasbourg), GANIL (Caen), ILL (Grenoble)






